基准医疗(AnchorDx)与中山大学附属第六医院的兰平教授和吴现瑞教授团队在Molecular Oncology(影响因子: 6.574)发表了一篇题为“A novel cell-free DNA methylation-based model improves the early detection of colorectal cancer”的研究论文。


基准医疗已上市产品
结直肠癌(CRC)是全球第三大最常见的恶性肿瘤,尽管治疗方法有所改善,但TNM晚期CRC患者的预后仍较差。I期CRC患者的5年生存率为91%,而IV期仅为14%。因此,对早期CRC的精准筛查是降低CRC相关死亡率的关键策略之一。
目前,CRC筛查方法主要分为有创结肠镜检查和无创大便CRC筛查,有创结肠镜检查存在对技术和设备要求高、检查前需要彻底清洁肠道、侵入性检查会带来一定的痛苦和并发症风险、患者依从性差等问题;而无创大便CRC筛查存在假阳性率高、非必要的治疗、价格相对较高、缺乏长期随访研究数据等问题,现阶段迫切需要一种高灵敏度和特异度的无创性CRC筛查产品。
本项目研究通过187个组织DNA样本(91个非恶性组织,26个进展期腺瘤[AA]和70个CRC)和489个血浆cfDNA样本进行靶向DNA甲基化测序,建立并验证了用于AA和早期CRC非侵入性检测的基于11个DNA甲基化生物标志物的cfDNA甲基化模型。

1、研究工作流程
为鉴定结直肠癌(CRC)特异的DNA甲基化生物标志物,研究者收集了313个组织样本(139例正常,30例进展期腺瘤[AA]和144例结直肠癌[CRC])进行靶向DNA甲基化二代测序(NGS)。此外,为进一步探索这些DNA甲基化标志物在CRC早期检测中的临床应用,采集了577例血浆样本(169例健康对照组、44例非进展期腺瘤[NAA]、76例AA和288例CRC)进行NGS测序分析。经过DNA提取、文库构建和DNA甲基化测序的质控,最终分析了187个组织样本和489个血浆样本。应用Wilcoxon检验和Benjamini-Hochberg多重检验筛选组织队列,得到了667个CRC特异的DNA甲基化生物标志物。将133例正常血浆样本和248例CRC血浆样本随机分组到训练和验证集中,进行建模分析,从该667个生物标志物中进一步筛选CRC特异甲基化生物标志物。在LASSO选择后,基于训练集获得11个CRC特异性甲基化生物标志物,然后使用验证集进一步确认。最终,通过对NAA、AA和CRC患者的诊断来评估该模型的临床价值。同时,通过与癌胚抗原(CEA)和碳水化合物抗原19-9(CA19-9)方法的比较,评估了该模型在CRC管理中的稳定性。(Figure 1)
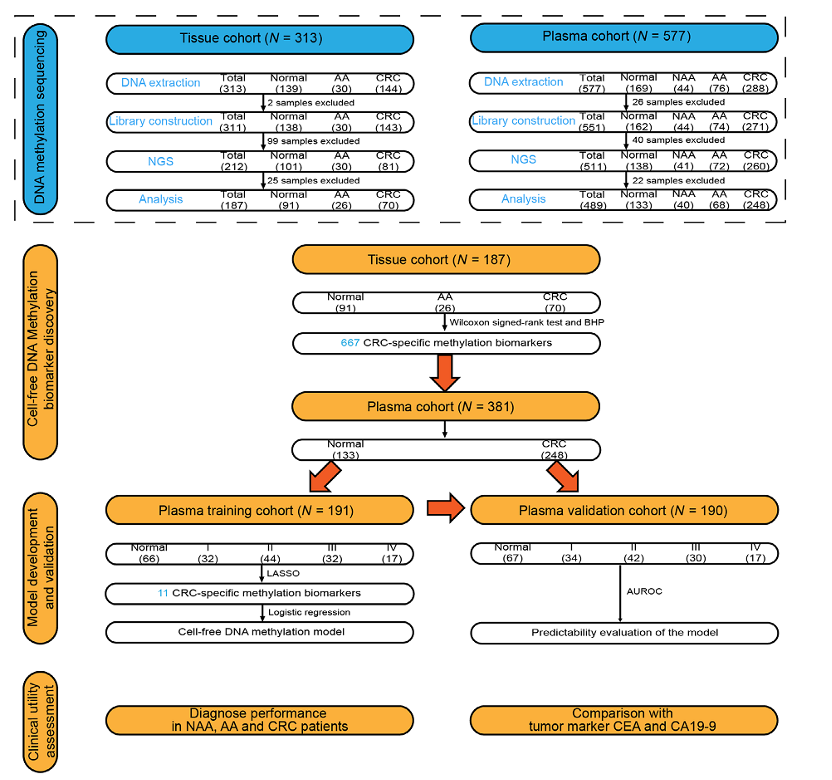
Figure 1. The study workflow chart.
2、健康对照组、NAA、AA和CRC患者的cfDNA提取分析
比较551例(162例健康对照[正常]、44例非进展期腺瘤[NAA]、74例进展期腺瘤[AA]、69例结直肠癌I期[I]、97例结直肠癌II期[II]、70例结直肠癌III期[III]、35例结直肠癌IV期[IV])cfDNA质控合格的样本的cfDNA浓度。数据显示为平均值±标准差(SD);ns,不显著(Figure 2,***p<0.001;****p<0.0001)。
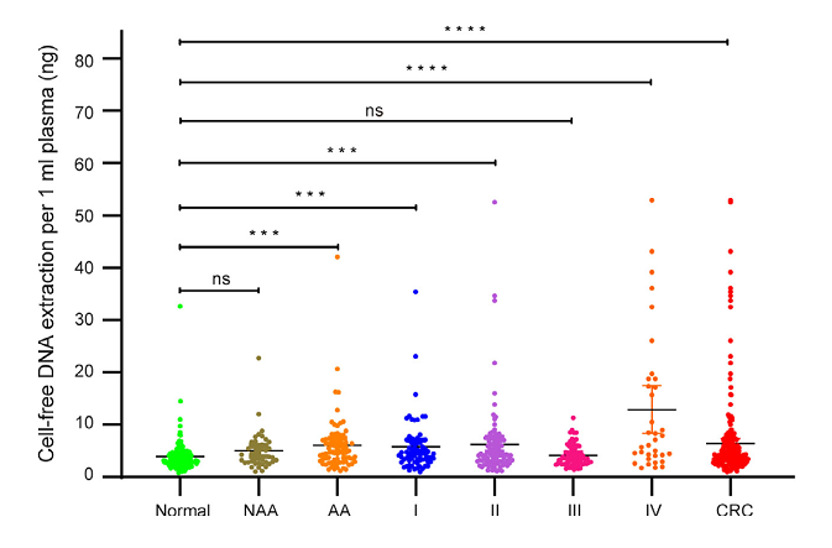
Figure 2. The cfDNA extraction analysis in healthy controls, NAA, AA, and CRC patients.
3、组织DNA甲基化图谱的表征
187个组织样本中667个结直肠癌(CRC)特异DNA甲基化生物标志物的无监督分层聚类分析(Figure 3A)。CRC、进展期腺瘤(AA)和正常样本的主成分分析(Figure 3B)。CRC与AA组甲基化模式的相关性分析(Figure 3C)。基于9921个生物标志物计算平均甲基化水平。图中的值是与正常样本共甲基化值(PCM)的比值,然后进行Log2转换来生成的。
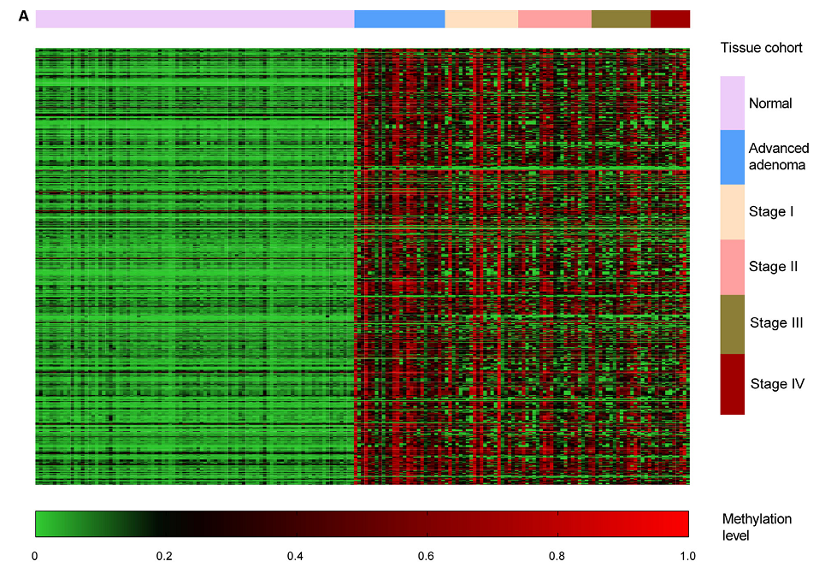
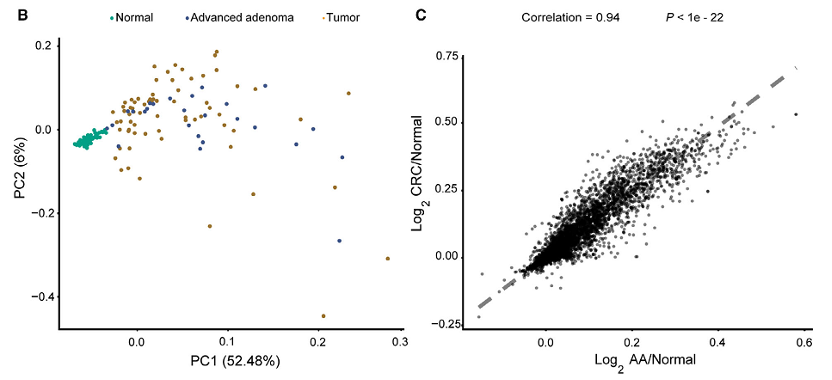
Figure 3. Characterization of the tissue DNA methylation landscape.
4、cfDNA甲基化模型检测腺瘤和CRC患者的性能和风险评分
在训练和验证集中,模型的ROC曲线下面积(AUC)分别为0.90(0.85-0.94)和0.92(0.88-0.96)(Figure 4A-B)。应用于腺瘤患者的诊断时,该模型在腺瘤、非进展期腺瘤(NAA)和进展期腺瘤(AA)中分别达到0.82(0.76-0.87)、0.77(0.69-0.86)和0.85(0.78-0.91)(Figure 4C-E)。该模型在I期结直肠癌检测中的AUC为0.90(0.86-0.95)(n=199)(Figure 4F)。该模型在结直肠癌(CRC)患者的诊断中表现突出,AUC为0.91(0.88-0.94)(n=381)(Figure 4G)。在CRC和AA队列(n=449)的检测中,模型的总体AUC为0.90(0.87-0.93)(Figure 4H)。模型在健康对照(正常)和NAA、AA以及结直肠癌I-IV期患者中的风险评分(n=489,配对t检验;Figure 4I,*****p<0.0001)。
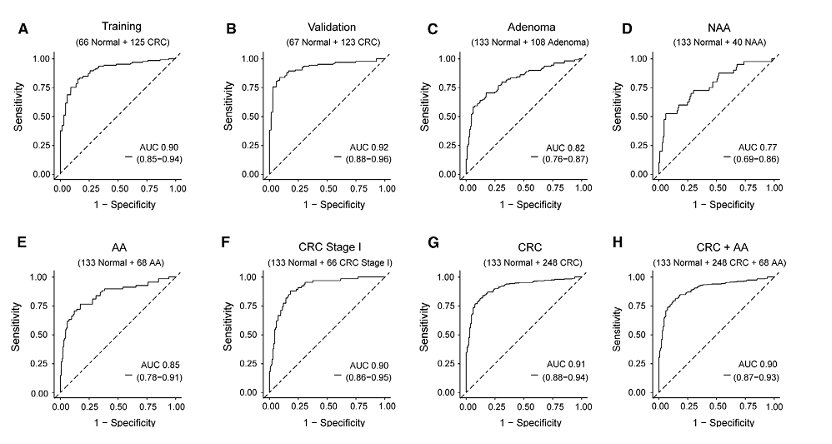
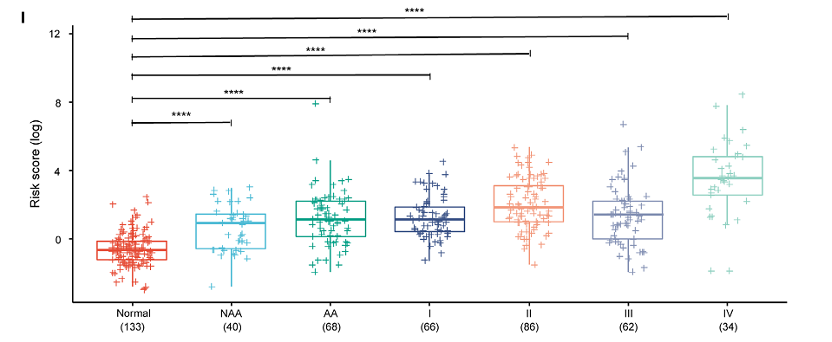
Figure 4. The performance and risk score of the cell-free DNA methylation model in detecting adenoma and CRC patients.
5、cfDNA甲基化模型与肿瘤生物标志物CEA和CA19-9的CRC诊断性能比较
cfDNA甲基化模型、癌胚抗原(CEA)和碳水化合物抗原19-9(CA19-9)检测结直肠癌(CRC)的ROC曲线下面积分别为0.91(0.88-0.94)、0.77(0.72-0.82)和0.59(0.53-0.65;Figure 5)。
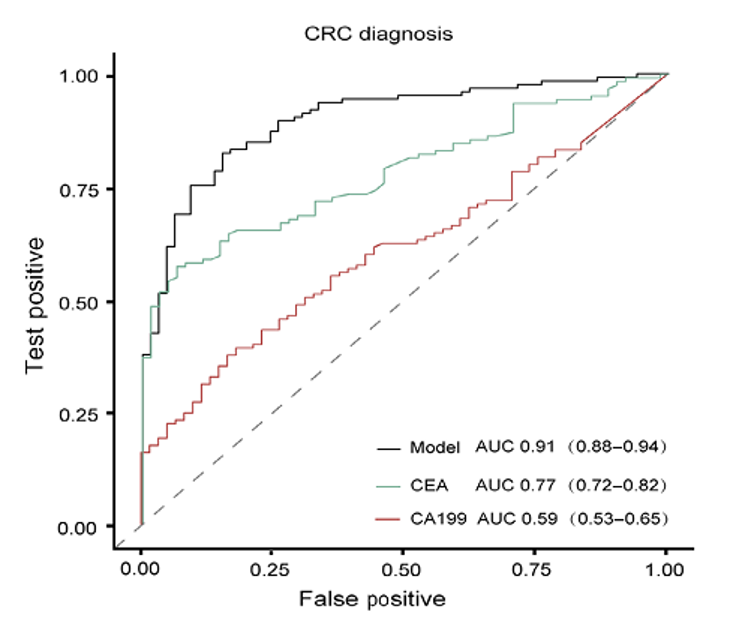
Figure 5. Comparison of CRC diagnostic performance between the cfDNA methylation model and the tumor biomarker CEA and CA19-9.
本研究建立并验证了用于AA和早期CRC非侵入性检测的基于11个DNA甲基化生物标志物的cfDNA甲基化模型。我们收集了来自CRC、进展期腺瘤(AA)、非进展期腺瘤和健康对照组的313个组织和577个血浆样本,去除质控不合格的,选择187个组织DNA样本(来自CRC患者的91个非恶性组织,26个AA和70个CRC)和489个血浆cfDNA样本进行靶向DNA甲基化测序。在训练队列中基于11个甲基化生物标志物(ROC曲线下面积[AUC]=0.90[0.85-0.94])开发了一个用于CRC检测的cfDNA甲基化模型,该模型在验证队列(AUC=0.92[0.88-0.96])中得到验证。本研究建立的cfDNA甲基化模型能够稳定地诊断出早期CRC(AUC=0.90[0.86-0.95])或AA(AUC=0.85[0.78-0.91])的患者。该模型将在CRC的早期诊断临床实践中发挥着积极作用。
原文链接:
https://febs.onlinelibrary.wiley.com/doi/full/10.1002/1878-0261.12942
◆ ◆ ◆ ◆ ◆
引领精准医疗,造福千家万户。
基准医疗介绍
基准医疗成立于2015年,由基因技术领域的世界级团队领军,是一家国际领先的采用甲基化高通量测序进行癌症早筛早诊产品开发的公司。
基准医疗是国內首家将ctDNA甲基化高通量测序技术用于肿瘤诊断的企业。自有技术包括效率高于市售同类产品10倍的甲基化建库技术AnchorIRIS和基于机器学习等算法的甲基化数据系统分析流程AnchorMonarch,同时,基准医疗还自主拥有以肺癌早筛早诊和治疗为中心的大数据和人工智能平台。
自创立以来,基准医疗一直致力于自主开发有真正临床价值的癌症早筛早诊产品, 目前产品研发管线覆盖了包括肺癌、乳腺癌、消化道癌和泌尿系统癌在内的超过70%高发癌种的单癌种、多癌种和泛癌种早筛早诊产品,其中有以下两款产品已面市,其他产品将陆续推出。
无创肺结节良恶性诊断产品PulmoSeek Plus -液影联动,双检合一!
全球首款实现液体活检与LDCT影像AI高效结合的早期肺癌诊断产品,多学科综合诊疗,帮助受检者选择更合适的诊疗方案。
无创膀胱癌早筛早诊产品UriFind -《中国泌尿疾病指南》准入产品!
准确、灵敏、便捷、无痛,帮助受检者早发现早治愈。




